Introdução
Em 2015, as mulheres representavam 51% dos 34,9 milhões de adultos vivendo com HIV no mundo.1 No Brasil, as mulheres representam 35% das pessoas vivendo com HIV/AIDS (PVHA). A maior concentração dos casos (49,8%) encontra-se entre a faixa etária de 25 a 39 anos.2
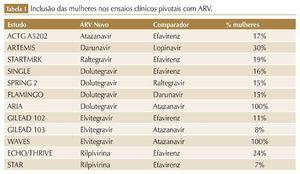
Entretanto, apesar da elevada e crescente participação na epidemia global do HIV, as mulheres ainda são sub-representadas nos estudos de pesquisa clínica. Dados de revisão sistemática mostram que a participação feminina é de apenas 19% nos estudos envolvendo antirretrovirais (ARV), 38% nos estudos de vacina e 11% nos estudos de cura.3
Portanto, diante da escassez de dados na literatura sobre diferenças de sexo e gênero em relação ao tratamento do HIV, as recomendações terapêuticas para as mulheres terminam sendo extrapoladas a partir de estudos em populações predominantemente do sexo masculino, mesmo sabendo-se que a eficácia da terapia antirretroviral (TARV) e a ocorrência de eventos adversos podem ser diferentes entre homens e mulheres.4
O objetivo deste artigo foi abordar algumas considerações específicas para o acompanhamento e tratamento de mulheres vivendo com HIV.
Eficácia e segurança da TARV em mulheres
No geral, os estudos clínicos envolvendo ARV apresentam restrições rigorosas em relação à gravidez e uso de contraceptivos. Por isso, historicamente, mulheres em idade fértil, gestantes ou lactantes são excluídas dessas pesquisas, principalmente devido à preocupação com potenciais danos ao feto ou alterações hormonais que possam alterar os resultados dos estudos.5,6 Além disso, muitos desses ensaios clínicos não relatam análises de subgrupos por sexo, e aqueles que o fazem não têm power para detectar diferenças significativas devido ao número limitado de participantes do sexo feminino. Quando as análises de subgrupo baseadas em sexo são relatadas, na maioria das vezes, geralmente são apenas para o endpoint primário de eficácia, e não abordam as diferenças de eventos adversos, resultando na atual falta de dados específicos para o manejo da TARV em mulheres (tabela 1).
Apesar de os estudos até agora não demonstrarem diferenças entre os sexos na resposta virológica à TARV,7-9 existem poucos dados que mostram que a farmacocinética para algumas drogas ARV pode diferir entre homens e mulheres, possivelmente devido a variações em fatores como peso corporal, volume de plasma, tempo de esvaziamento gástrico, níveis de proteína do plasma, atividade do citocromo P450 e excreção.10,11
Alguns estudos têm sugerido que o gê nero pode influenciar a frequência, a apre sentaçãoe a gravidade de alguns eventos adversos relacionados aos ARV.
Alguns estudos têm sugerido que o gênero pode influenciar a frequência, a apresentação e a gravidade de alguns eventos adversos relacionados aos ARV. Por exemplo: as mulheres são mais propensas a desenvolver hepatotoxicidade sintomática grave com uso da nevirapina12,13 e acidose láctica sintomática com o uso prolongado de inibidores da transcriptase reversa (ITRNs) mais antigos, como zidovudina, estavudina e didanosina.14
Diante dos poucos dados disponíveis sobre segurança e eficácia da TARV em mulheres, o estudo GRACE foi realizado com um grande esforço para recrutar um número maior de mulheres, que representaram 67% dos participantes. Foi um estudo norte-americano, fase IIIB, desenhado exatamente para avaliar as diferenças de tratamento entre mulheres (n = 287) e homens (n = 142) recebendo darunavir/ ritonavir (DRV/r) 600/100 mg duas vezes ao dia, pois eram indivíduos já experimentados à TARV, em que 84% dos participantes eram negros ou hispânicos. O estudo não revelou diferenças em função do sexo na eficácia de esquemas contendo DRV/r durante 48 semanas (p = 0,067).15 As diferenças baseadas no gênero em resposta ao DRV/r, embora não significativas, foram atribuídas em grande parte às maiores taxas de abandono em mulheres em comparação com os participantes do sexo masculino (32,8 vs. 23,2%; p = 0,042). A incidência global de eventos adversos não foi afetada pelo gênero, mas náuseas foram mais comuns em mulheres do que em homens (5,2 vs. 2,8%), ao passo que a diarreia foi ligeiramente menos comum (4,5 vs. 4,9%).
Até o momento, apenas dois estudos foram desenhados para incluir exclusivamente mulheres e avaliar eficácia, segurança e tolerabilidade da TARV na população feminina vivendo com HIV, e ambos envolveram inibidores da integrase (INI) no início da TARV.
O WAVES foi o primeiro a incluir uma amostra com 100% de mulheres. É um estudo clínico randomizado, internacional, duplo cego de fase III, que compara o elvitegravir potencializado com o cobicistat (EVG/c) ao atazanavir com reforço do ritonavir (ATV + RTV), ambos com a utilização da dupla de análogos tenofovir/emtricitabina (TDF/FTC), para mulheres que nunca haviam utilizado a TARV (ART-naïve). Os critérios de elegibilidade incluíram ainda carga viral (CV) acima de 500 cópias/mL e taxa de filtração glomerular estimada acima de 70 mL/min. O endpoint primário foi a proporção de mulheres com supressão virológica (CV < 50 cópias/mL) ao final da semana 48, e os endpoints secundários foram variação na contagem de células CD4 na semana 48, segurança e perfil de resistência na falha.16 No total, 575 mulheres foram incluídas. O endpoint primário foi alcançado em aproximadamente 87% das mulheres com EVG/c e 81% das mulheres no braço de ATV + RTV, indicando superioridade do EVG/c (diferença no tratamento de 6,5% [IC 95%: 0,4-12,6]), independentemente dos níveis iniciais de CD4 e CV, mas especialmente naquelas com CV mais elevadas (> 100.000 cópias/mL). Houve ganho semelhante de células CD4 entre os braços, assim como não houve diferenças no desenvolvimento de disfunção renal, eventos adversos renais ou alterações na densidade mineral óssea (DMO). Porém, ocorreu maior aumento nos níveis de colesterol total no braço do EVG/c. Houve diferença no número de descontinuações por efeitos adversos, as quais foram em grande parte impulsionadas pela tolerabilidade, com mais mulheres no grupo de ATV + RTV com desenvolvimento de icterícia, hiperbilirrubinemia ou efeitos adversos gastrintestinais. É importante ressaltar que as mulheres que ficaram grávidas durante o estudo foram autorizadas a continuar com a droga do estudo.
O objetivo primário foi a indetecção da CV (< 50 cópias/ mL) na se mana 48.
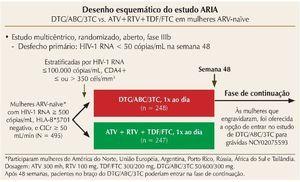
O estudo ARIA, também randomizado, internacional, duplo cego de fase III, compara dolutegravir (DTG) associado a abacavir/lamivudina (ABC/3TC) (dose fixa combinada, uma vez ao dia) ao ATV + RTV + TDF/FTC em mulheres ART-naïve. Mais uma vez, o objetivo primário foi a indetecção da CV (< 50 cópias/mL) na semana 48.17 Os critérios de elegibilidade incluíram mulheres com CV > 500 cópias/ mL, sem tratamento prévio, que tinham HLA-B*5701 negativo, e um clearance de creatinina superior a 50 mL/min (figura 1). O estudo incluiu 495 mulheres, e os resultados de 48 semanas foram recentemente apresentados na Conferência Internacional de AIDS em Durban, mostrando que o endpoint primário foi alcançado em aproximadamente 82% das mulheres com DTG e 71% das mulheres no braço de ATV + RTV, indicando superioridade do DTG (diferença no tratamento de 10,5% [IC 95%: 3,1-17,8; p = 0,005]), independentemente dos níveis de CD4 e CV iniciais. Novamente, o esquema com INI foi superior em comparação com o esquema com inibidor de protease (IP), e parte dessa eficácia superior foi impulsionada pelo menor número de interrupções devido a eventos adversos (4 vs. 7%, com maior risco relativo de tosse, cefaleia, dispepsia, hiperbilirrubinemia e icterícia no braço do ATV + RTV) e menos falhas virológicas (6 vs. 14%). Não houve surgimento de mutações primárias associadas ao INI ou ABC/3TC no braço do DTG/ABC/3TC. Em ambos os braços, às mulheres que engravidaram foi oferecida a opção de entrar na fase estendida do estudo DTG/ABC/3TC para gestantes (NCT02075593).
Figura 1. Desenho esquemático do estudo ARIA.
TARV e contracepção hormonal
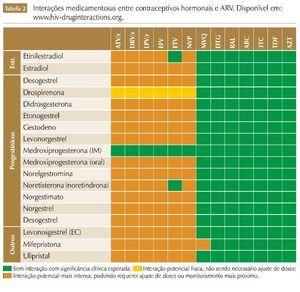
Diante da TARV, não há contraindicação de método contraceptivo. No entanto, há que se atentar para as diversas interações medicamentosas entre os contraceptivos hormonais e os ARV, que podem reduzir a eficácia contraceptiva ou aumentar os efeitos adversos.
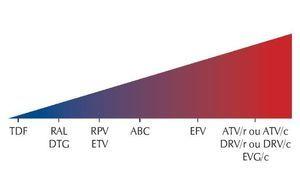
Vários IPs, o EFV e o EVG/c têm interações medicamentosas com diversos contraceptivos orais combinados. Uma diminuição ou aumento nos níveis sanguíneos de etinilestradiol (EE), noretindrona ou norgestimato pode diminuir potencialmente a eficácia contraceptiva ou aumentar os eventos adversos relacionados com o estrogênio/progesterona, como o tromboembolismo. Por exemplo, ao utilizar-se o ATV + RTV, os contraceptivos orais precisam conter no mínimo 35 mcg EE, e com o ATV sem o RTV, os contraceptivos orais devem conter no máximo 30 mcg EE (ambos podem ser usados com o acetato de medroxiprogesterona - AMP). De maneira geral, os ITRN e os INI são as classes com menor potencial de interações significativas com os contraceptivos hormonais,18-20 podendo o RAL e o DTG ser utilizados com quaisquer contraceptivos, inclusive os orais, sem impacto esperado na eficácia (figura 2).
Figura 2. Efeito dos ARV nos lipídeos.
Quando há interações medicamentosas significativas, um método contraceptivo alternativo ou adicional é recomendado para evitar a gravidez indesejada. O uso consistente do preservativo é recomendado tanto para prevenir a transmissão do HIV quanto para compensar qualquer possível redução da eficácia da contracepção hormonal. Realizar a mudança para um ARV sem interações com contraceptivos hormonais também pode ser considerado (tabela 2).
Os ARV utilizados durante a gestação de vem ser efetivos no tratamento de adultos não grávidos e devem ser seguros e bem tolerados.
TARV durante a gestação
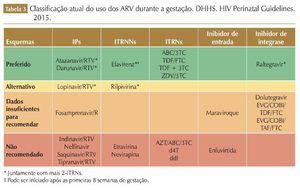
Os ARV utilizados durante a gestação devem ser efetivos no tratamento de adultos não grávidos e devem ser seguros e bem tolerados. Geralmente, os esquemas consistem na associação de dois ITRN/ITRNt e um ITRNN ou um IP/r. Porém, a mulher que engravida em uso de TARV deverá continuar o esquema já em uso se o mesmo estiver sendo efetivo e bem tolerado, pois a troca de esquemas ARV durante a gestação pode estar associada com supressão viral incompleta no final do período gestacional, aumentando o risco de transmissão perinatal.21 Considerações na escolha da TARV para gestantes devem incluir: eficácia, durabilidade, toxicidade, conveniência, dados de PK na gestação, e efeitos adversos para mãe/feto/criança (tabela 3).
Na TARV de primeira linha paragestan tes recomendada pelo PCDT Brasileiro e pela OMS, o EFV é o ITRNN de escolha, independentemente da idade gestacio nal.
Na TARV de primeira linha para gestantes recomendada pelo PCDT Brasileiro e pela OMS, o EFV é o ITRNN de escolha, independentemente da idade gestacional.22,23 Porém, segundo as orientações do DHHS, o EFV pode ser usado apenas após as primeiras oito semanas de gravidez.18 Isso se deve ao fato de, inicialmente, por alguns relatos de defeitos congênitos tanto em primatas (anencefalia, microftalmia e fenda palatina) quanto em humanos (defeitos de tubo neural), o uso do EFV ter sido contraindicado no primeiro trimestre de gestação ou em mulheres com desejo de engravidar.
Entretanto, em 2010 foi publicada pela primeira vez uma revisão sistemática e metanálise sobre o uso de EFV no primeiro trimestre da gestação.24 Essa revisão já foi atualizada duas outras vezes, e na última atualização (2014)25 foram incluídos 23 estudos, com um total de 2.026 nascidos-vivos de gestantes expostas ao EFV no primeiro trimestre da gestação. Os resultados mostram que não houve diferença no aumento do risco de anomalias congênitas entre os grupos expostos e não expostos ao EFV (RR: 0,78; IC 95%: 0,56-1,08). A incidência de defeitos no tubo neural foi baixa, 0,05% (IC 95%: 0,01-0,28) e similar à incidência na população geral. Portanto, essa revisão não mostrou evidência de risco aumentado para anomalias em geral e/ ou do sistema nervoso central em conceptos de gestantes expostas ao EFV no primeiro trimestre da gestação. A partir de então, a maior parte das diretrizes passou a permitir o uso do EFV também durante o primeiro trimestre da gestação.22,23,26-28
Há que se ter conhecimento também sobre a prevalência local de resistência transmitida aos ITRNN antes de iniciar a TARV com EFV em gestantes, pois nem sempre o resultado da genotipagem estará disponível em tempo hábil, e uma única mutação pode conferir resistência de alto nível para os ITRNN. Na ausência do resultado da genotipagem pré-TARV, deve-se avaliar a possibilidade da introdução da TARV baseada em INI (ATV/r ou LPV/r) em áreas com prevalência elevada de resistência transmitida aos ITRNN.
Esquemas à base de RAL podem causar uma redução significativa mente mais rápida na CV do HIV (aproximadamente 2 log em duas semanas) em comparação com um esquema conven cional.
É importante salientar que não há estudos bem controlados com RAL em mulheres grávidas.
Problema ainda presente em nosso meio, a apresentação tardia das gestantes aos cuidados de saúde (> 28 semanas de gestação) é uma das razões para manutenção da transmissão vertical do HIV, tendo em vista o pouco tempo disponível para indetectar a CV materna até o parto. Portanto, faz-se necessário utilizar um esquema ARV potente e que garanta uma queda rápida na CV. O raltegravir (RAL) é uma droga FDA categoria C que, assim como outros INI, promove uma queda rápida na CV quando em monoterapia (vs. efavirenz) ou em associação com outros ARV. Esquemas à base de RAL podem causar uma redução significativamente mais rápida na CV do HIV (aproximadamente 2 log em duas semanas), em comparação com um esquema convencional.29 O RAL também é efetivamente transferido por meio da barreira placentária, causando um efeito de pré-carga para o recém-nascido, e este é considerado um fator potencial de proteção contra a transmissão do HIV in utero.30,31 Além disso, também demonstrou um acúmulo rápido e eficaz nas secreções cérvico-vaginais.32 Essas são propriedades desejáveis nos ARV utilizados para a prevenção da transmissão vertical do HIV, especialmente entre as mulheres que terão parto vaginal, quando a criança estará potencialmente exposta ao vírus do trato genital durante a passagem pelo canal do parto. Essas características fazem do RAL um potencial candidato para prevenir a transmissão vertical do HIV e tratar as gestantes apresentadoras tardias. É importante salientar que não há estudos bem controlados com RAL em mulheres grávidas. No entanto, há diversos relatos de casos e séries de casos que mostraram uma diminuição rápida na CV com a utilização de RAL iniciado no final da gravidez para alcançar a supressão viral e reduzir o risco de transmissão perinatal do HIV.33,34 Apesar de ainda não haver dados comparativos disponíveis na gravidez, existem alguns estudos clínicos randomizados que estão atualmente em andamento, tanto com o RAL (NCT01854762 e NCT01618305) quanto com o DTG (NCT02245022 e NCT02075593), e para ambos já há dados de estudos de farmacocinética na gestação.35,36
As diretrizes do EACS e BHIVA recomendam que para gestantes que iniciam o seguimento com > 28 semanas e CV do HIV desconhecida ou > 100.000 cópias/ mL, deve-se considerar a adição de um INI (RAL) ao esquema (tabela 4).26,28
Manejo da TARV em mulheres com comorbidades
Quando comparadas às mulheres HIV-negativo, as mulheres vivendo com HIV apresentam um risco maior de desenvolver algumas comorbidades que podem impactar na TARV.
Doença cardiovascular
A infecção pelo HIV tem sido associada a um risco aumentado de doença cardiovascular (DCV) em mulheres.
A infecção pelo HIV tem sido associada a um risco aumentado de doença cardiovascular (DCV) em mulheres (infarto agudo do miocárdio, angina instável, acidente vascular encefálico e insuficiência cardíaca),37,38 que pode ser causada especificamente pelo HIV ou por fatores de risco cardiovasculares tradicionais, tais como hipertensão, diabetes, tabagismo, triglicérides elevados e níveis mais baixos de colesterol HDL,39 dentre outros.
Dados da Veterans Aging Cohort Study que envolveu 2.187 mulheres (32% HIV+) mostraram que mulheres HIV+ tiveram um risco aumentado de doenças cardiovasculares, em comparação com HIV- (HR = 2,8; IC 95%: 1,7-4,6; p < 0,001).40
Uma associação entre o uso de ABC e infarto agudo do miocárdio foi relatada pela primeira vez no estudo D:A:D. Nesse estudo observacional, o uso recente (dentro de seis meses) ou corrente de ABC foi associado com um aumento do risco de infarto do miocárdio, particularmente nos participantes com fatores de risco cardíaco preexistentes.41 Outros estudos têm avaliado a relação entre a terapia com ABC e eventos cardiovasculares. Alguns estudos encontraram associação.42,43 Outros, incluindo a metanálise do FDA com de 26 ensaios clínicos randomizados que avaliaram ABC, não encontraram tal evidência.44,45
Os seguintes ARV foram associados com dislipidemia: IP/r ou IP/c, EFV e EVG/c. DTG e RAL têm menos efeitos lipídicos. TDF tem sido associado com os efeitos lipídicos mais favoráveis do que ABC ou TAF.
Osteoporose
Outra comorbidade com maior prevalência em indivíduos que vivem com o HIV é a osteoporose.
Em um grande estudo de base populacional dos Estados Unidos, a prevalência global de fratura foi de 2,87 vs. 1,77 pacientes com fraturas por cada 100 pessoas em infectados pelo HIV, em comparação com pacientes não infectados pelo HIV (p < 0,0001).46 Entre as mulheres, a prevalência global de fratura foi 2,49 vs. 1,72 por 100 pessoas em infectados pelo HIV vs. pacientes não infectados pelo HIV (p = 0,002). Nesse estudo, a infecção pelo HIV em mulheres foi associada a maior prevalência de fraturas vertebrais (0,81 vs. 0,45; p = 0,01) e do punho (1,31 vs. 0,83; p = 0,01) (em relação a mulheres não infectadas pelo HIV), enquanto a prevalência de fraturas de quadril não foi afetada pelo status de HIV (0,47 vs. 0,56; p = 0,53). Um estudo adicional com 128 mulheres hispânicas e afro-americanas na pós-menopausa com e sem HIV relatou menor DMO, aumento do metabolismo ósseo e maiores taxas de perda óssea nas mulheres com HIV.47
O uso de TDF tem sido associado com diminuição da função renal, tubulopatia renal proximal (levando à proteinúria e perda de fosfato) e redução na DMO. Também há um risco aumentado de fraturas quando existe associação entre TDF e um IP/r. O início da TARV tem sido associado com uma diminuição de 2 a 6% na DMO, independentemente do esquema ARV utilizado. Entretanto, a perda de DMO é maior com esquemas contendo TDF. Por exemplo, em dois estudos randomizados que comparam TDF/FTC com ABC/3TC, o braço dos indivíduos que receberam TDF/FTC experimentou um declínio significativamente maior na DMO que o braço do ABC/3TC.48,49 No estudo ACTG 5257, esquema baseado em INI (RAL) mostrou causar menos perda de massa óssea quando comparado a esquema com IP/r (ATV/r e DRV/r) para pacientes em início de tratamento.50
A depressão é uma comorbidade de gran de relevância clínica em PVHA.
Depressão
A depressão é uma comorbidade de grande relevância clínica em PVHA. É um dos diagnósticos psiquiátricos mais comuns observados nessa população, com uma prevalência estimada de 20 a 60%.51,52 Em estudos que examinaram correlações específicas de gênero, o sexo feminino foi identificado como um importante preditor de triagem positivo para depressão.53 Além disso, as associações entre estigma54 relacionadas com o HIV e distúrbios psíquicos em geral foram identificadas como importantes preditores de depressão em mulheres que vivem com o vírus.55 Foi demonstrada associação, também, entre depressão e progressão mais rápida da doença em homens,56,57 e entre depressão e mortalidade em mulheres.58
Sintomas de depressão, incluindo agitação, humor deprimido e insônia, estão ligados a medicamentos comumente usados em pacientes que vivem com HIV, e isso pode influenciar as estratégias da TARV. Deve-se considerar a triagem de rotina para a depressão principalmente em pacientes do sexo feminino, de idade avançada ou com histórico de várias alterações na TARV.
Sabe-se que o EFV é menos tolerado que outros ARV comparadores e que ele pode causar efeitos secundários no SNC (por exemplo, sonhos anormais, tonturas, dor de cabeça, depressão), os quais desaparecem na maioria dos pacientes após algum tempo de uso. Porém, uma análise de quatro estudos comparativos (AIDS Clinical Trial Group – ACTG) mostrou maior taxa de suicídio (ideação suicida ou tentativa de suicídio ou suicídio efetivado) entre os pacientes tratados com EFV quando comparados àqueles que fizeram uso de outros esquemas que não continham EFV (HR: 2,58; IC 95%: 0,94-7,06; p = 0,065).59 Os principais fatores de risco encontrados nesse estudo foram história psiquiátrica documentada ou uso de medicação psicoativa no prazo de 30 dias antes de entrar no estudo (HR: 3,75; IC 95%: 2,33-6,03; p < 0,001). Essa associação, no entanto, não foi encontrada em análises de três grandes coortes observacionais.60,61 No entanto, na Conferência Internacional de AIDS deste ano, novos dados do estudo START foram apresentados, mostrando que os participantes que utilizaram EFV no grupo de TARV imediata, particularmente aqueles com diagnóstico de doença psiquiátrica prévia (depressão maior, transtorno bipolar, transtorno psicótico incluindo esquizofrenia), tiveram um risco aumentado de comportamento suicida em comparação com controles virgens de tratamento (HR: 4,16; IC 95%: 1,2-14,4; p = 0,02).62
TARV inicial para mulheres vivendo com HIV
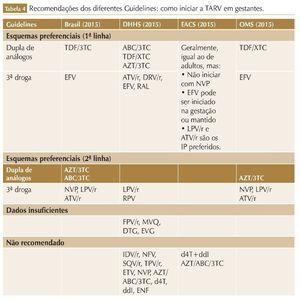
Existem discrepâncias entre as atuais diretrizes nacionais e internacionais para os pacientes virgens de tratamento. Segundo os consensos da IAS, DHHS e EACS, a primeira linha de tratamento recomendada é baseada nos INI; porém, Brasil e OMS ainda recomendam o início com o EFV, apesar de a OMS ter incluído também o DTG no esquema alternativo em sua última revisão.23,26,27,63,64
O EFV deixou de fazer parte do esquema preferencial em muitas diretrizes após vários ensaios clínicos demonstrarem a superioridade de outros esquemas, quando comparados com EFV,65-68 principalmente devido à toxicidade e tolerabilidade, em especial toxicidade para o SNC e o aumento do risco de suicídio,59 além da prevalência de resistência transmitida aos ITRNN69 e baixa barreira genética do medicamento para o desenvolvimento de resistência adquirida.
Sabemos que características de um ou mais componentes do esquema prescrito podem afetar a adesão à TARV. As mulheres são mais propensas que os homens a interromper o tratamento nos estudos de pesquisa, e por razões diferentes.15,70,71 Esquemas mais simples, com apenas uma tomada ao dia, com número pequeno de comprimidos, sem a exigência de alimentos e com poucos efeitos colaterais ou toxicidade, estão associados a níveis mais elevados de adesão em ambos os sexos.
Vários fatores podem predispor indivíduos a efeitos adversos dos ARV. Portanto, o médico prescritor deve considerar os potenciais efeitos adversos na escolha de um esquema ARV, bem como comorbidades individuais da paciente, medicações concomitantes e história prévia de intolerância às drogas.
As mulheres têm um risco aumentado de osteopenia, osteoporose e fraturas, especialmente após a menopausa, e esse risco é agravado pelo HIV e pela TARV. Esquemas ARV que contêm TDF, IP/r ou ambos estão associados a uma perda de DMO significativamente maior do que esquemas contendo outros ITRNs e RAL. Esquemas poupadores de ITRN, ou com ABC e TAF, podem ser considerados alternativas ao TDF em pacientes que estão em risco de osteoporose ou osteopenia. Substituir o TDF por um INI também é uma opção terapêutica nesse cenário. Mulheres com risco cardiovascular elevado devem evitar esquemas contendo ABC e LPV/r, se possível. Mulheres podem ter distúrbios psiquiátricos exacerbados pelo EFV e disfunção renal limítrofe ou leve, aumentando o risco de nefrotoxicidade associada ao TDF (tabela 5).
Eficácia e segurança são fundamentais na escolha do esquema ARV.
Conclusões
Eficácia e segurança são fundamentais na escolha do esquema ARV, mas é importante que esses dados sejam disponibilizados a partir de estudos envolvendo uma amostra representativa das mulheres vivendo com HIV. Até o momento, as recomendações terapêuticas para as mulheres são extrapoladas a partir de estudos com populações majoritariamente do sexo masculino, que excluem questões importantes sobre saúde sexual e reprodutiva, presença de comorbidades e climatério.
Na escolha da TARV ideal para mulheres, devemos considerar a compatibilidade dos ARV com contracepção, gravidez, presença de comorbidades e estratégias de prevenção ao HIV, individualizando sempre cada escolha.